Простые и сложные белки
Содержание:
- Коллаген
- II.Глобулины
- 1.1. Глобулярные белки
- Презентация на тему Понятие о белках и их классификация Понятие о белках и их классификация Белки, или протеины. В переводе с греческого протос — первый, главный. Находятся. Транскрипт
- Гистоны
- Краткая история открытия сложных белков
- Хромопротеины
- Физико-химические свойства белков.
- Липид-белковые комплексы
- Строение, классификация и функции витаминов
- Строение и классификация ферментов.
- Характеристика небелковых групп, входящих в состав сложных белков
- Структура белка
Коллаген
Фибриллярный белок с уникальной структурой. Обычно содержит моносахаридные (галактоза) и дисахаридные (галактоза-глюкоза) остатки, соединенные с ОН-
группами некоторых остатков гидроксилизина. Составляет основу межклеточного
вещества соединительной ткани сухожилий, кости, хряща, кожи, но имеется, конечно, и в других тканях. Полипептидная
цепь коллагена включает 1000 амино-
кислот и состоит из повторяющегося триплета , где А и В – любые,
кроме глицина аминокислоты. В основ-
ном это аланин, его доля составляет 11%, доля пролина и гидроксипролина –
21%. Таким образом, на оставшиеся
аминокислоты приходится всего 33%. Структура пролина и гидроксипролина
не позволяет образовать а-спиральную
структуру, из-за этого образуется левозакрученная спираль, где на один виток
приходится 3 аминокислотных остатка. Гидроксилирование пролина осуществляет фермент пролилгидроксилаза, железо-содержащий фермент, для его полноценной работы необходим витамин С (аскорбиновая кислота). Недостаточность аскорбиновой кислоты в пище обуславливает возникновение цинги. Приматы и морские свинки утратили способность синтезировать аскорбиновую кислоту и, поэтому, должны получать ее с пищей. Являясь сильным вос-
становительным агентом, аскорбиновая кислота предохраняет от инактивации пролилгидроксилазу, поддерживая восстановленное состояние атома железа в ферменте. Коллаген, синтезированный в отсутствие аскорбиновой кислоты, оказывается недогидроксилированным и не может образовывать нормальные по структуре волокна, что приводит к поражению кожи и ломкости сосудов.
Молекула коллагена построена из 3 полипептидных цепей, сплетенных между собой в плотный жгут – тропоколлагена (длина=ЗОО нм, d=1,6 нм). Полипептидные
цепи прочно связаны между собой через ε-аминогруппы остатков лизина. Тропокол-
лаген формирует крупные коллагеновые фибриллы (d=10-300 нм). Фибриллы очень прочны, они прочнее стальной проволоки равного сечения. Поперечная исчерчен-
ность фибриллы обусловлена смещением молекул тропоколлагена друг относи-
тельно друга на 1/4 их длины.
Вкоже фибриллы образуют нерегулярно сплетенную и очень густую сеть –
выделанная кожа представляет собой почти чистый коллаген.
Время полужизни коллагена исчисляется неделями и месяцами. Ключевую роль в его обмене играет коллагеназа, расщепляющая тропоколлаген на 1/4 расстояния с С-конца между Гли и Лей.
Врезультате распада коллагена образуется гидроксипролин. При поражении
соединительной ткани (болезнь Пейджета, гиперпаратиреоидизм) экскреция гидро-
ксипролина возрастает и имеет диагностическое значение. По мере старения организма в тропоколлагене образуется все большее число поперечных связей, что де-
II.Глобулины
Глобулины
характеризуются более сбалансированным
чем у альбуминов , аминокислотным
составом.
Молекулярная
масса — от 100000 дальтон и выше.
Глобулины
растворимы лишь в слабых солевых
растворах, зато растворимы в дистиллированной
воде и крепких солевых растворах.
Глобулины являются слабо кислыми или
нейтральными белками. ИЭТ находится в
интервале рН 6-7,3. Обладая небольшим
отрицательным зарядом в нейтральной
или слабощелочной среде, глобулины
характеризуются более низкой, чем у
альбуминов, электрофильной подвижностью.
Глобулины
широко распространены в природе. В
больших количествах они содержатся в
плазме крови и различных тканях. На долю
глобулина приходится около половины
(42-46%) всех белков плазмы крови
Изменение
соотношения альбумины/глобулины
(белкового коэффициента) имеет важное
диагностическое значение
При
электрофорезе белков сыворотки крови
глобулины разделяются на ряд фракций
1,
2,
,
,
которые представлены различными группами
белков, выполняющих различные функции.
К
1-глобулинам,
в частности, относятся белки, осуществляющие
транспорт липидов, билирубина;
К
2-глобулинам
белки, осуществляющие транспорт липидов,
а также гаптоглобин
белок, стабилизирующий гемоглобин;
К
-глобулинам
относятся белки, осуществляющие транспорт
липидов, железа, меди, а также протромбин
— важнейший компонент системы свертывания
крови;
III.
Протамины.
Протамины являются простыми белками.
Их аминокислотный состав характеризуется
высоким содержанием аргинина (до 80-85%)
и ограниченным набором (6-8) других
аминокислот (аланина, валина, глицина,
изолейцина, пролина, серина).
Первичная
структура протаминов содержит
повторяющуюся единицу (арг-арг-арг-Х-Х),
где Х-алифатический остаток.
Молекулярная
масса 400012000
дальтон.
Протамины
хорошо растворимы в воде и слабых
кислотах, не осаждаются при кипячении.
Протамины
являются поликатионными (основными)
белками, их ИЭТ находится в интервале
рН 1013.
Обладая в нейтральной среде большим
положительным зарядом, протамины легко
реагируют с молекулами, имеющими
избыток отрицательно заряженных групп,
в частности, с нуклеиновыми кислотами.
Протамины
широко распространены в природе. В
больших количествах они содержатся в
сперме позвоночных.
Образуя
прочный комплекс с ДНК, протамины
выполняют в хроматине структурную
функцию. Протамины придают ДНК
биохимическую инертность, что является
необходимым условием сохранения
наследственных свойств организма.
IY.
Гистоны.
Аминокислотный состав гистонов
характеризуется высоким содержанием
аргинина и (или) лизина
на их долю приходится 20-30% всех
аминокислотных остатков. Гистоны не
содержат триптофана и, в большинстве
случаев, цистеина. В зависимости от
соотношения лизина и аргинина различают
5 фракций гистонов
H1
H2а
,
H2в
H3,
H4.
Первичная
структура гистонов содержит повторяющуюся
единицу арг ( или лиз )ХХХ
, где Халифатический
остаток.
Молекулярная
масса
1100024000
дальтон.
Гистоны
хорошо растворимы в слабых кислотах,
осаждаются спиртом, аммиаком.
Гистоны
являются поликатионными (основными)
белками, их ИЭТ находится в интервале
рН 9,512,0.
Обладая в нейтральной среде большим
положительным зарядом, гистоны легко
реагируют с молекулами, имеющими избыток
отрицательно заряженных групп, в
частности, с нуклеиновыми кислотами.
Гистоны
широко распространены в природе. Это
важнейшие белки клеточных ядер, они
содержатся также в эритроцитах.
Основные
функции гистонов
структурная и регуляторная.
Структурная
функция гистонов состоит в том, что
гистоны участвуют в стабилизации
пространственной структуры ДНК и РНК.
В частности, гистоны H1,
H2а
,Н2в
,
H3,
H4
являются составными частями нуклеосом,
а гистон Н1
стабилизирует линкерную ДНК.
Регуляторная
функция заключается в их способности
контролировать экспрессию генов, т.е.
в контроле передачи генетической
информации от ДНК и РНК.
1.1. Глобулярные белки
Они довольно сложно
организованы, имеют третичную структуру,
поэтому растворимы в воде. Из-за
направленности заряда их делят на:
-
Основные. В
этих белках содержится много основных
аминокислот (аргинина и лизина), что
позволяет им приобретать положительный
заряд, облегчая растворимость.
Наиболее яркие
представители:
Протамины —
самые
маленькие низкомолекулярные белки (Мr
5000 Д), впервые выявлены в зрелой сперме
некоторых рыб. Включают до 85% аргинина.
Являются основными компонентами
нуклеопротеидов
хроматина ядра спермиев, а также
полирибосом, что сохраняет и регулирует
передачу генетической информации при
делении клеток и между особями.
Гистоны
–белки
с большей, чем у протаминов, молекулярной
массой от 11 до 21 тыс. Д. Вклад основных
аминокислот лизина и аргинина меньше
и составляет от 20 до 30%. Это гетерогенная
фракция. Различают 5 классов гистонов:
Н1,
Н2а,
Н2b,Н3,
Н4.
Их молекулы (кроме Н1)
легко взаимодействуют друг с другом,
образуя мультимеры – октамеры.
В свободном виде они не встречаются, а
входят в состав сложных белков –
нуклеопротеидов
(рис. 10), выполняя следующие функции:
структурную и регуляторную. Первая
заключается в формировании и стабилизации
пространственной компановки молекулы
ДНК. Вторая обусловлена тем, что –
находясь в связи с этим хранителем
информации, они блокируют её передачу
на РНК.
Кислые. Это
широко распространённые белки в основном,
внеклеточных жидкостей. Наиболее богаты
ими плазма крови, лимфа, ликвор, молоко
и т.д. Из-за преобладания в них кислых
аминокислот (глутамата и аспартата)
растворы имеют кислый характер.
К ним относят:
Альбумины. Их
Мr
= 40-70 тыс.Д. Молекулы представляют одну
полипептидную цепь небольших размеров.
Из-за высокого содержания глутаминовой
кислоты имеют солидный отрицательный
заряд. Это сильно гидратированные белки
(с огромной гидратной оболочкой), поэтому
осаждаются только при большой концентрации
водоотнимающих средств, а также устойчивы
к нагреванию.
Характерным
свойством альбуминов является их
способность связывать лиганды и
адсорбировать на своей поверхности
вещества, перенося их с током биологической
жидкости. Таким способом в комплексе
с ними плазмой крови доставляются к
клеткам гормоны, липиды, витамины,
лекарства, яды, катионы металлов и т.д.;
кроме того эти протеины обеспечивают
онкотическое давление плазмы крови и
являются её составляющей буферной
системы.
Глобулины –
это белки с большой молекулярной массой
свыше 150 тыс. Д. По сравнению с альбуминами
в их составе меньше кислых аминокислот.
В отличие от них это слабо гидратированные
мицеллы, поэтому легко высаливаются.
Кроме того они гетерогенны, что
подтверждается при электрофорезе на
бумаге, после разгонки регистрируют
пять фракций: 1,
2,
β1,
β2,.
Последняя (нейтральные глобулины)
является самой крупной и наиболее
разнообразной. В ней сосредоточены
некоторые факторы свёртывания крови и
различные антитела (иммуноглобулины).
Отсюда следует, что глобулины выполняют
не только функции, подобные альбуминам,
но и предохраняют организм от неадекватных
кровопотерь и участвуют в его иммунной
защите. Они являются составляющей
сложных белков – гликопротеинов
и липопротеинов.
Соотношение
величин альбуминов и глобулинов в плазме
крови называется белковым
коэффициентом ().
В норме он сохраняется
на постоянном уровне и составляет 1,5 –
2,3. Данный параметр изучают с целью
диагностики различных патологических
состояний. Например:
при инфекционных заболеваниях после
разделения белков плазмы крови оценивают
соотношение величин альбуминов и
глобулинов и находят белковый коэффициент
().
Если организм борется с инфекцией, то
закономерно повышается уровень иммунных
защитников -глобулинов
в крови, что снижает значения дроби:
белковый коэффициент 1,5.
Если не борется (что плохо), то величины
остаются в пределах нормы, следовательно,
врачебная тактика должна быть более
активной: требуется дополнительное
введение иммуностимуляторов (веществ,
усиливающих образование антител) или
готовых -глобулинов.
Презентация на тему Понятие о белках и их классификация Понятие о белках и их классификация Белки, или протеины. В переводе с греческого протос — первый, главный. Находятся. Транскрипт
1
Понятие о белках и их классификация Понятие о белках и их классификация Белки, или протеины. В переводе с греческого «протос» — первый, главный. Находятся в протоплазме и ядре всех растительных и животных клеток, являются главными носителями жизни. Альбумин (в курином яйце) Гемоглобин (в крови человека) Казеин (в коровьем молоке) Миоглобин и миозин (в мышцах) «Жизнь есть способ существования белковых тел» (Ф. Энгельс)
2
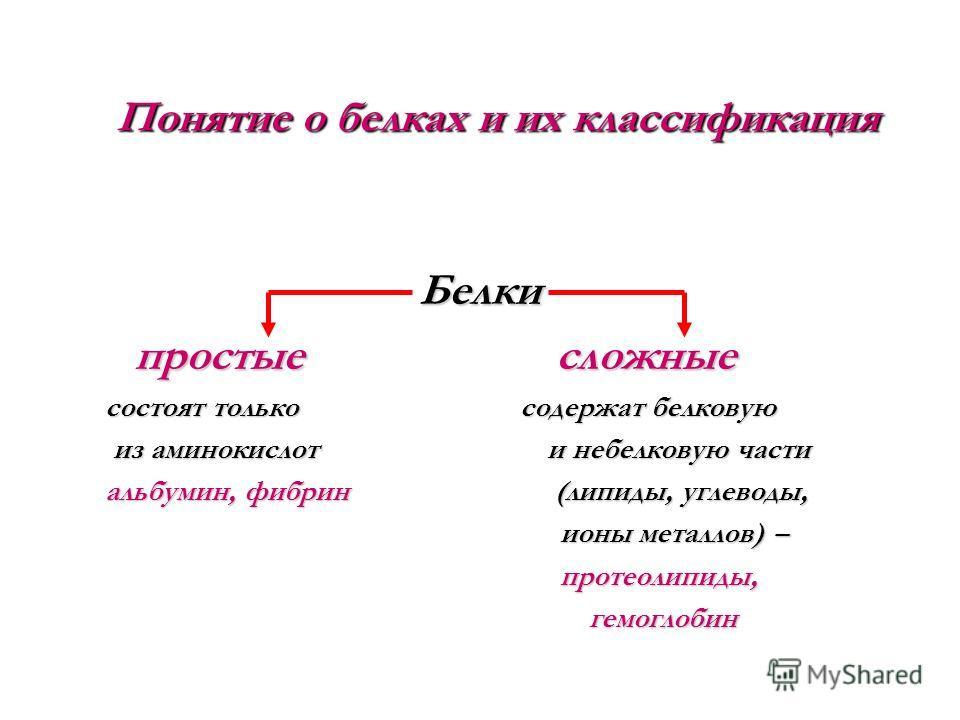
Белки простые сложные простые сложные состоят только содержат белковую состоят только содержат белковую из аминокислот и небелковую части из аминокислот и небелковую части альбумин, фибрин (липиды, углеводы, альбумин, фибрин (липиды, углеводы, ионы металлов) – ионы металлов) – протеолипиды, протеолипиды, гемоглобин гемоглобин Понятие о белках и их классификация Понятие о белках и их классификация
3
Белки – сложные высокомолекулярные природные соединения, построенные из α-аминокислот Аминокислоты в белках связаны пептидными связями боковые радикалы одинаковых или различных аминокислот Около 20 видов аминокислот входят в состав белков. Состав белков
4
Степень организации белковых молекул
5
Первичная структура белка Последовательность аминокислот в полипептидной цепи, соединенных между собой пептидными связями (прочные ковалентные связи) Последовательность аминокислот в полипептидной цепи, соединенных между собой пептидными связями (прочные ковалентные связи)
6
Вторичная структура белка Полипептидная цепь скрученная в спираль, удерживающаяся посредством образования слабых, но многочисленных водородных связей между остатками карбоксильной и амино- группами разных аминокислот Полипептидная цепь скрученная в спираль, удерживающаяся посредством образования слабых, но многочисленных водородных связей между остатками карбоксильной и амино- группами разных аминокислот
7
Третичная структура белка Спираль, в свою очередь, свернута в форме глобулы или шара. Эта структура удерживается водородными, ионными, ковалентными, дисульфидными связями и гидрофобными взаимодействиями. Каждому белку свойственна в определенной среде своя особая пространственная структура.
8
Четвертичная структура белка представляет собой объединение в единую структуру нескольких молекул с третичной организацией (гемоглобин, инсулин) представляет собой объединение в единую структуру нескольких молекул с третичной организацией (гемоглобин, инсулин)
9
Строение белковой молекулы
10
Особенности структур белковой молекулы Первичная структура – самая прочная.Первичная структура – самая прочная. По степени усложнения структуры (вторичная, третичная, четвертичная) прочность ее уменьшается.По степени усложнения структуры (вторичная, третичная, четвертичная) прочность ее уменьшается. Четвертичная структура – самая слабая.Четвертичная структура – самая слабая. Прочность структуры определяется прочностью химических связей, которые ее поддерживают.Прочность структуры определяется прочностью химических связей, которые ее поддерживают. Белковая молекула способна к денатурации – нарушению природной целостности (нарушению структуры белковой молекулы) под действием различных факторов.
11
Классификация белков по выполняемым функциям Классификация белков по выполняемым функциям Структурная Каталитическая Регуляторная Сократительная Транспортная Защитная Запасная Защитная Кератин Каталаза Инсулин Миозин Гемоглобин Антитела Казеин Токсины растений
Гистоны
Белки массой ММ=24 кД. Обладают выраженными основными свойствами, т.е. при физиологических рН заряжены положительно и, поэтому связываются с ДНК.
Существуют 5 типов гистонов:
•Н1 – очень богат Лиз (29%),
•Н2а – умеренно богат Лиз (11%)
иApr (9,5%),
•H2b – умеренно богат Лиз (16%)
иApr (6,5%),
•НЗ – умеренно богат Лиз (10%) и
Apr (13,5%),
•Н4 – умеренно богат Лиз (11%) и
Apr (14%).
Радикалы аминокислот в составе
гистонов могут быть ферментативно метилированы, ацетилированы или фосфо-
рилированы. Это изменяет суммарный
заряд и другие свойства белков.
Функция
1.Регулируют активность генома, а именно
–препятствуют транскрипции,
2.Структурная – стабилизируют простран-
ственную структуру ДНК.
Гистоны образуют нуклеосомы (укорочение в 7 раз), далее суперспираль и „суперсу-
перспираль». Тем самым они участвуют в плотной упаковке ДНК при формировании
хромосом. Благодаря гистонам размеры ДНК
уменьшаются в тысячи раз: ведь длина ДНК достигает 6-9 см (10-1), а размеры хромосом –
всего несколько микрометров (10-6)
Краткая история открытия сложных белков
Целенаправленно изучать функции и строение сложных белков ученые начали во второй половине 18 века, а французский химик Антуан Франсуа де Фуркруа в результате научных экспериментов получил такие макроэлементы, как глютен, альбумин и фибрин. Сложные белки были выделены учеными в отдельную молекулярную группу.
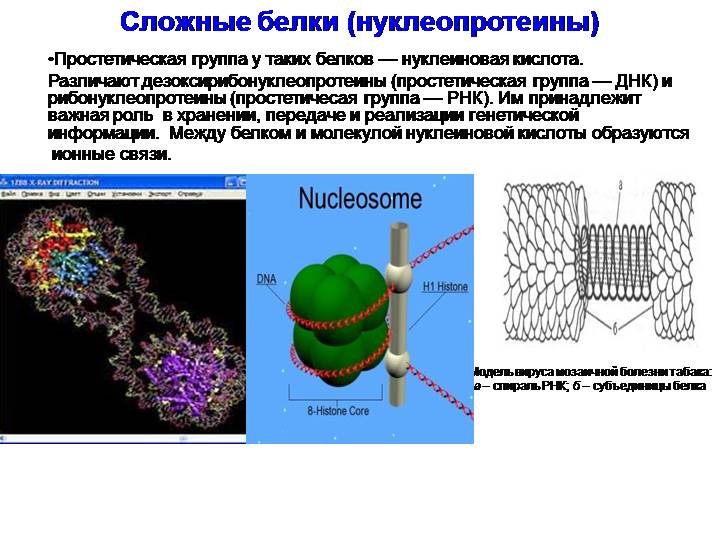
Сложныке белки
Что касается первой модели химического строения белков, то она была изобретена в 1838 году, а предложил ее Мулдер, основываясь на теории радикалов. До 1850 года данная модель считалась общепризнанной, а в 1852 г. белки стали называться протеинами. Во второй половине 19-го века специалисты приступили к изучению аминокислот, из которых состоят протеины. В 1895 г. немецким ученым Альбрехтом Косселем была выдвинута теория, в которой он утверждал, что аминокислоты — это основные структурные элементы сложных белков.
Обратите внимание! Классы сложных белков в биохимии являются высокомолекулярными органическими веществами. В состав молекулы протеина входят сотни аминокислот, которые представлены цепочкой пептидной связи
Хромопротеины
Для них простетическая
часть окрашена (chromos – краска). К
хромопротеинам относятся гемоглобин,
миоглобин, каталаза, пероксидаза, ряд
флавинсодержащих ферментов
(сукцинатдегидрогеназа, альдегидоксидаза,
ксантиноксидаза), цитохромы (гемсодержащие
белки) и т.д. Велика биологическая роль
этих белков – участвуют в физиологических
процессах: дыхание клетки, транспорте
кислорода и углекислого газа,
окислительно-восстановительных
процессах.
Гемоглобин.
Его белковая часть представлена глобином,
небелковая – гемом. Это олигомерный
белок, т.е. имеет четвертичную структуру,
состоящую из 4 субъединиц.
цепи
построены из 141 АК-остатка.
цепи
из 146 АК-остатков .
Каждая
из субъединиц связана с гемом:
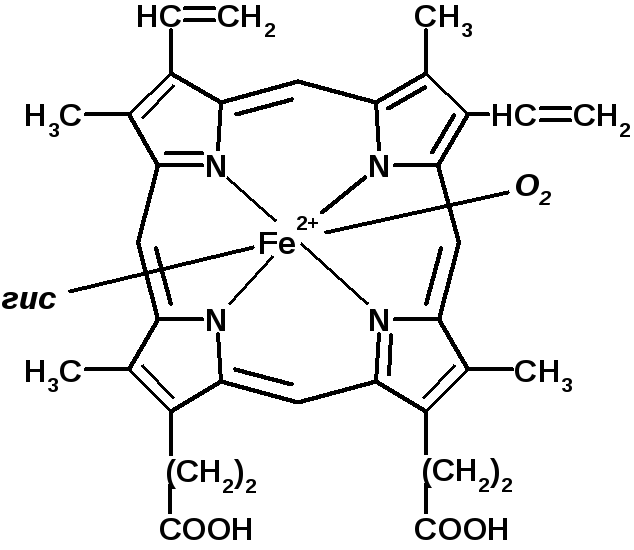
Основная функция
гемоглобина – транспортная (кислород,
углекислый газ). Также он представляет
собой основную буферную систему крови
(75% от всей буферной емкости крови).
Различают:
—
HbO2
– оксигемоглобин (связан с молекулой
O2);
— HbCO – карбоксигемоглобин;
—
HbCO2
– карбгемоглобин;
— HbOH – метгемоглобин
(образуется при соединении с
нитросоединениями, не способен связывать
кислород).
Типы
гемоглобина.
Всего известно более 100 типов, но их все
делят на 2 группы:
1)
Физиологические гемоглобины;
2)
Патологические
(аномальные).
К
физиологическим
гемоглобинам относятся:
— Hb P – примитивный
гемоглобин, имеет место быть у 1-2
недельного эмбриона;
— Hb F – фетальный
или гемоглобин плода, к моменту рождения
составляет около 70% всего гемоглобина
в крови;
—
Hb A, Hb A2,
Hb A3
– это гемоглобины взрослого организма.
На Hb A приходится около 90-96%.
Физиологические
типы гемоглобинов отличаются глобулиновой
частью (АК-составом). Например Hb A содержит
2
и 2b
субъединицы, а Hb F – 2
и 2
субъединицы.
К
аномальным
(возникающих при наследственных
заболеваниях) гемоглобинам относятся:
—
HbS – гемоглобин, сопутствующий
серповидно-клеточной анемии. Отличается
от нормального тем, что с N-конца в 6
положении b–цепи
глутамин заменен на валин.
Миоглобин
по сравнению с гемоглобином имеет
третичную структуру, одну полипептидную
цепь, один гем и может связывать одну
молекулу кислорода. Гемоглобин и
миоглобин функционируют вместе.
Гемоглобин доставляет кислород из
легких к тканям, а миоглобин перераспределяет
его внутри клетки (доставляет к
митохондриям).
Оба белка –
гемопротеины, т.е. гемсодержащие белки.
Физико-химические свойства белков.
Одной из главных
особенностей белков является их большая
молекулярная масса,
которая колеблется в диапазоне от 6000
до нескольких миллионов дальтон.
Другим важным
физико-химическим свойством белков
является их амфотерность,
то есть наличие, как кислотных, так и
основных свойств.
Амфотерность связана с наличием в
составе некоторых аминокислот свободных
карбоксильных групп, то есть кислотных,
и аминогрупп, то есть щелочных. Это
приводит к тому, что в кислой среде белки
проявляют щелочные свойства, а в щелочной
среде – кислотные. Однако при определенных
условиях белки проявляют нейтральные
свойства. Значение рН, при котором белки
проявляют нейтральные свойства,
называется изоэлектрической
точкой.
Изоэлектрическая
точка для каждого белка индивидуальна.
Белки по этому показателю делят на два
больших класса – кислые
и щелочные, так
как изоэлектрическая точка может быть
сдвинута либо в одну, либо в другую
сторону.
Еще одно важное
свойство белковых молекул – это
растворимость.
Несмотря на
большой размер молекул белки довольно
хорошо растворимы в воде. Причем растворы
белков в воде весьма устойчивы
Первой
причиной растворимости белков является
наличие на поверхности молекул белков
заряда, благодаря чему белковые молекулы
практически не образуют нерастворимые
в воде агрегаты. Второй причиной
устойчивости белковых растворов является
наличие у белковой молекулы гидратной
(водной) оболочки. Гидратная оболочка
отделяет белки друг от друга.
Третье важное
физико-химическое свойство белков –
это высаливание,
то есть
способность выпадать в осадок под
действием водоотнимающих средств.
Высаливание – процесс обратимый. Эта
способность то переходить в раствор,
то выходить из него очень важна для
проявления многих жизненных свойств
Наконец, важнейшим
свойством белков является его способность
к денатурации.
Денатурация
— это потеря белком нативности.
Когда мы делаем яичницу на сковороде,
мы получаем необратимую денатурацию
белка. Денатурация заключается в
постоянном или временном нарушении
вторичной и третичной структуры белка.,
но при этом первичная структура
сохраняется. Помимо температуры(выше
50 градусов) денатурацию могут вызвать
другие физические факторы: излучении,
ультразвук, вибрация, сильные кислоты
и щелочи. Денатурация может быть обратимой
и необратимой. При небольших воздействиях
разрушение вторичной и третичной
структур белка происходит незначительное.
Поэтому белок при отсутствии
денатурирующего воздействия может
восстановить свою нативную структуру.
Процесс обратный денатурации называется
ренатурация.
Однако при
продолжительном и сильном воздействии ренатурация
становится невозможной, а денатурация,
таким образом, необратимой.
Липид-белковые комплексы
Липид-белковые
комплексы –
сложные белки, простетическую часть
которых составляют различные липидные
компоненты.
К таким компонентам относятся:
1.
предельные и непредельные ВЖК. К
предельным относятся стеариновая
С17Н35СООН
и пальмитиновая С15Н31СООН;
к непредельным – олеиновая С17Н33СООН,
линолевая С17Н31СООН,
линоленовая С17Н29СООН
и др.;
2.
простые и смешанные триацилглицериды.
К простым относится трипальмитин, а к
смешанным – олеодистеарин :
СН2— О — СО — С15Н31СН2— О — СО — С17Н33
| |
СН — О — СО — С15Н31СН — О — СО —
С17Н35
| |
СН2— О — СО — С15Н31СН2— О — СО — С17Н35
3.
фосфолипиды – сложные эфиры глицерина,
ВЖК, остатка фосфорной кислоты и
гидроксилсодержащего компонента
(холин, серин, этаноламин, инозит и др.).
СН2— О — СО — О — РО2Н — О — С2Н4-NH2
|
СН — О — СО — С17Н35
|
СН2— О — СО — С17Н35
4.
холестерин (холестерол), его эфиры. В
основе холестерина лежит
циклопентанпергидрофенантрен.
Связывание
белковой и простетической части может
осуществляется за счет:
—
ионных связей, что характерно для связи
фосфолипидов с белковой частью;
—
гидрофобных взаимодействий между
гидрофобным участком белковой молекулы
и более гидрофобным участком простетической
части.
Липопротеины.
Делятся на:
—
свободные липопротеины (ЛП) – хорошо
растворимые в воде вещества, транспортные
формы (доминируют белки);
—
структурные протеолипиды – хорошо
растворимые в органических растворителях.
К
свободным ЛП относят транспортные ЛП
крови. В
составе этих частиц могут быть ВЖК,
триацилглицерины, фосфолипиды,
холестерин, холестериды и др. Наружная
часть — -полярные
соединения (гидрофильные): белки,
фосфолипиды, холестерин. В центре
частицы локализованы холестериды,
эфиры ВЖК, триацилглицириды, фосфолипиды
. Все их можно разделить по
плотности и по электрофоретической
подвижности:
1.
хиломикроны
(ХМ) – самые крупные и наименее плотные
(
2.
ЛП очень
низкой плотности
(ЛПОНП) – по электрофоретической
подвижности эта фракция предшествует
-ЛП
(пре--ЛП).
Их плотность =0,94 – 1,006 кг/л. Содержат
повышенное количество белка. Образуются
в печени, осуществляют транспорт
триглицеридов из нее;
3.
ЛП низкой
плотности
(ЛПНП) – по электрофоретической
подвижности -ЛП.
Плотность от 1,006 до 1,06 кг/л;
4.
ЛП высокой
плотности
(ЛПВП) – по электрофоретической
подвижности -ЛП.
Плотность от 1,06 до 1,2 кг/л. Содержат
примерно 60% белка.
По
составу липидов, ЛП низкой и высокой
плотности богаты холестерином и
фосфолипидами.
Биологическая
роль свободных ЛП сводится к транспортным
функциям. За счет их гидрофильной
оболочки происходит перенос различных
веществ в клетки. Также они играют
важную роль в диагностике патогенеза.
ЛПНП
и ЛПОНП относятся к атерогенным ЛП,
т.к. они богаты холестерином и являются
крупными частицами, поэтому они
застревают в сосудах и вызывают
разрастание соединительной ткани.
ЛПВП
– это антиатерогены, т.к. транспорт
холестерина ими происходит из клеток
в ткани.
Структурные
липопротеины.
Они плохо растворяются в воде, но хорошо
в других растворителях. Участвуют в
построении биомембран. Содержат 65-85%
белка, находящийся в центре частицы и
окружен липидами — поэтому их называют
протеолипиды. В составе структурных
ЛП важную роль играют фосфолипиды.
Биологическая роль структурных ЛП
заключается в транспорте веществ через
клеточные мембраны, передаче нервного
импульса и выполнении ими ферментативной
функции.
Строение, классификация и функции витаминов
Витамины — это низкомолекулярные органические соединения различного химического состава. Практически в растениях синтезируются все витамины, так как провитамины, которые используют затем животные для создания витаминов животного происхождения, тоже имеют растительное происхождение (например провитамин А и витамин Д).
История открытия витаминов крайне интересна (болезни, Н.И. Лунин) — на самостоятельное изучение.
Витамины классифицируются на:
водорастворимые (С, В, РР, Н, пантотеновая кислота, инозит, фолиевая кислота, пара-аминобензойная кислота),
жирорастворимые (А, Д, Е, К).
Для растений особенно важны витамины группы В,РР, тиамин, ниацин, пиридоксин. Особенно нуждаются в притоке витаминов от фотосинтезирующих органов нефотосинтезирующие органы растения (корни, цветки, плоды).
Функция витаминов — участие в биохимических процессах в составе ферментов.
Строение и классификация ферментов.
Ферменты — это
белки, выполняющие функция катализатора
при прохождении в клетке биохимических
реакций.
Ферменты могут
быть как простыми, так и сложными белками.
Если фермент относится к сложным белкам,
то его белковая часть называется
апоферментом,
а небелковая (простетическая группа) —
коферментом.
Существуют
и ферменты, в состав которых входит
несколько апоферментов и коферментов.
В физиологии существует отдельная
отрасль науки — энзимология, которая
занимается изучением ферментов,
разрабатывает практические вопросы
синтеза и использования ферментов в
пищевой промышленности и медицине.
Ферменты делятся на шесть классов по
типу реакции, которая катализируется:
оксидоредуктазы
(реакции восстановления и окисления),
трансферазы
(перенос химических групп от молекулы
к молекуле),
гидролазы
(расщепление химических связей в реакциях
гидролиза),
лиазы (образование
двойных связей либо отщеплением, либо
присоединением определенных химических
групп),
изомеразы,
лигазы (соединение
молекул с использованием АТФ).
Систематическое
название молекулы фермента составляют
из названия субстрата и названия класса
фермента, например, глюкозооксидаза
в соответствии с принципами систематики
ферментов правильно именуется
бета-д-глюкоза,
кислород-1-оксидоредуктаза.
Механизм действия фермента состоит в
образовании комплекса ES
между ферментом и субстратом, после
чего из субстрата образуется продукт
ЕР, который затем распадается на фермент
и продукт. Субстрат связывается активным
центром фермента, который часто является
простетической группой или коферментом.
В ряде случаев в ферменте помимо основного
активного центра имеются еще дополнительные
активные центры, которые называются
аллостерическими.
Ферменты, имеющие
основной и аллостерические активные
центры, называют аллостерическими.
В любой живой клетке, в том числе и в
растительной, ферменты бывают двух
категорий: конститутивные
или
обязательные, адаптивные
или индуцированные, то есть образующиеся
под влиянием условий внешней среды в
ответ на воздействие ее факторов. Если
из окружающий среды в клетку поступают
какие-либо факторы, разрушающие
конститутивные ферментативные системы
и их синтез, а, следовательно, и
биохимические реакции, которые
катализировались с их помощью прекращаются,
то такие ферменты называют репрессированными.
Характеристика небелковых групп, входящих в состав сложных белков
В большинстве случаев, небелковая группа протеогликанов состоит из больших углеводных цепей, в которых периодически повторяются дисахаридные остатки, представлены аминосахаром или уроновой кислотой. В зависимости от того, какую структуру имеют углеводные цепи, можно выделить их различные типы. Распространенным гликозаминогликаном является гепарин и гиалуроновая кислота, которая активно применяется в косметологических целях.
Обратите внимание! Что касается нуклеопротеинов, то они отвечают за регуляцию и хранение генетического материала, а также работу рибосом, от которых зависит процесс синтеза белка
Важной функциональной ролью отличается фосфатная группа, потому что практически все сложные протеины с ней связаны. В клетках фосфатной группы регулярно происходит дефосфорилирование и фосфорилирование, что, в свою очередь, оптимизирует работу белков
В клетках фосфатной группы регулярно происходит дефосфорилирование и фосфорилирование, что, в свою очередь, оптимизирует работу белков.
Стоит заметить, что небелковые группы, из которых состоят сложные белки, определяют степень их термопластичности, растворимости, а также изменяют заряд. К примеру, таким эффектом отличаются моносахариды и фосфорная кислота. Сложный макроэлемент состоит из углеводной части, которая предотвращает разрушение из-за процесса гидролиза, а также влияет на сортировку и секрецию молекул, проникающих через клеточную мембрану. Белковые каналы для транспортировки гидрофобных соединений можно классифицировать с помощью липидных фрагментов.
Обратите внимание! Функции и структура небелковых элементов зависит от того, какой тип у простетической группы. К примеру, железосодержащий гем в гемоглобине способствует связыванию углекислого газа и кислорода
Структура белка
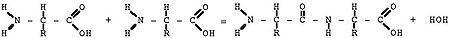
Схематическое
изображение образования пептидной
связи (справа). Подобная реакция происходит
в молекулярной машине по образованию
белка — рибосоме
Молекулы белков представляют собой
линейные полимеры, состоящие из
α-L-аминокислот
(которые являются мономерами) и, в
некоторых случаях, из модифицированных
основных аминокислот (правда, модификации
происходят уже после синтеза белка на
рибосоме). Для обозначения аминокислот
в научной литературе используются одно-
или трёхбуквенные сокращения. Хотя на
первый взгляд может показаться, что
использование в большинстве белков
«всего» 20 видов аминокислот ограничивает
разнообразие белковых структур, на
самом деле количество вариантов трудно
переоценить: для цепочки всего из 5
аминокислот оно составляет уже более
3 миллионов, а цепочка из 100 аминокислот
(небольшой белок) может быть представлена
более чем в 10130вариантах. Белки
длиной от 2 до нескольких десятков
аминокислотных остатков часто называютпептидами, при большей степени
полимеризации —белками, хотя это
деление весьма условно.
При образовании белка в результате
взаимодействия α-аминогруппы (-NH2)
одной аминокислоты с α-карбоксильной
группой (-СООН) другой аминокислоты
образуются пептидные связи. Концы белка
называют С- и N- концом (в зависимости от
того, какая из групп концевой аминокислоты
свободна: -COOH или -NH2, соответственно).
При синтезе белка на рибосоме новые
аминокислоты присоединяются к C-концу,
поэтому название пептида или белка
даётся путём перечисления аминокислотных
остатков начиная с N-конца.
Последовательность аминокислот в белке
соответствует информации, содержащейся
в гене данного белка. Эта информация
представлена в виде последовательности
нуклеотидов, причём одной аминокислоте
соответствует в ДНК последовательность
из трёх нуклеотидов — так называемый
триплет или кодон. То, какая аминокислота
соответствует данному кодону в мРНК,
определяется генетическим кодом, который
может несколько отличаться у разных
организмов. Так как аминокислоты
синтезируются на рибосомах из 20-ти
аминокислот, а триплетов, которыми они
закодированы в ДНК, у разных организмов
от 61 до 63, то большинство аминокислот
может быть закодировано разными
триплетами (генетический код вырожденный,
или избыточный).
Сравнение
аминокислотных последовательностей
белков (в данном случае — гемоглобинов)
из разных организмов позволяет определять
участки, важные для функционирования
белков, а также эволюционную историю
сравниваемых видов
Гомологичные белки (предположительно
имеющие общее эволюционное происхождение
и нередко выполняющие одну и ту же
функцию), например, гемоглобины разных
организмов, имеют во многих местах цепи
идентичные, консервативныеостатки
аминокислот. В других местах находятся
различные аминокислотные остатки,
называемыевариабельными. По степени
гомологии (сходства аминокислотной
последовательности) возможна оценка
эволюционного расстояния между таксонами,
к которым принадлежат сравниваемые
организмы.