Белки
Содержание:
- Классификация аминокислот в соответствии с полярностью их r-групп.
- Классификация аминокислот по растворимости их радикалов в воде
- Потребность в белках для людей старше 60 лет
- Критика метода азотного баланса
- Вводная часть
- Общие структурные особенности аминокислот, входящих в состав белков
- Список литературы
- Химические реакции, используемые для обнаружения аминокислот
- Белковое питание должно быть полноценным.
- Модифицированные аминокислоты, найденные в составе белков
Классификация аминокислот в соответствии с полярностью их r-групп.
1.
неполярные R-группы:
аланин, изолейцин, лейцин, метионин,
пролин, триптофан, фенилаланин
2.
полярные, но незаряженные: аспарагин,
глицин, глутамин, серин, тирозин, треонин,
цистеин.
3.
отрицательно заряженные: аспарагиновая
кислота, глутаминовая кислота
4.
положительно заряженная: аргинин,
гистидин, лизин.
-
-
Физико-химические
свойства белков (амфотерность,
стереоизомерия).
-
На
физических свойствах белков, таких как
ионизация,
гидратация, растворимость
основаны различные методы выделения
и очистки белков.
Так
как белки содержат ионогенные, т.е.
способные к ионизации аминокислотные
остатки (аргинин, лизин, глутаминовая
кислота и т.д.), следовательно, они
представляют собой полиэлектролиты.
При подкислении степень ионизации
анионных групп снижается, а катионных
— повышается, при подщелачивании
наблюдается обратная закономерность.
При определенном рН число отрицательно
и положительно заряженных частиц
становится одинаковым, такое состояние
называется изоэлектрическим
(суммарный заряд молекулы равен нулю).
Значение рН, при котором белок находится
в изоэлектрическом состоянии, называют
изоэлектрической
точкой и
обозначают рI.
На различной ионизации белков при
определенном значении рН основан один
из методов их разделения — метод
электрофореза.
Полярные
группы белков (ионогенные и неионогенные)
способны взаимодействовать с водой,
гидратироваться. Количество воды,
связанное с белком достигает 30-50 г на
100 г белка. Гидрофильных групп больше
на поверхности белка. Растворимость
зависит от количества гидрофильных
групп в белке, от размеров и формы
молекул, от величины суммарного заряда.
Совокупность всех этих физических
свойств белка позволяет использовать
метод молекулярных
сит или
гель-фильтрацию
для
разделения белков. Метод диализа
используется для очистки белков от
низкомолекулярных примесей и основан
на больших размерах молекул белка.
Растворимость
белков зависит и от наличия других
растворенных веществ, например,
нейтральных солей. При высоких
концентрациях нейтральных солей белки
выпадают в осадок, причем для осаждения
(высаливания)
разных белков требуется разная
концентрация соли. Это связано с тем,
что заряженные молекулы белка адсорбируют
ионы противоположного заряда. В
результате частицы теряют свои заряды
и электростатическое отталкивание, в
результате происходит осаждение белка.
Методом высаливания можно фракционировать
белки.
Классификация аминокислот по растворимости их радикалов в воде
АК
с неполярными Rрадикалы,
имеющие алифатические углеводородные
цепи (радикалы ала, вал, лей, изо, про и
мет) и ароматические кольца (радикалы
фен и три).
АК
с полярными незаряженными Rэти
радикалы
лучше, чем гидрофобные радикалы,
растворяются в воде, т.к. в их состав
входят полярные функциональные группы,
образующие водородные связи с водой. К
ним относят сер, тре и тир, имеющие
гидроксильные группы, асн и глн, содержащие
амидные группы, и цис с его тиольной
группой.
Цистеин
и тирозин содержат соответственно
тиольную и гидроксильную группы,
способные к диссоциации с образованием
Н+,
но при рН около 7,0, поддерживаемого в
клетках, эти группы практически не
диссоциируют.
АК
с полярными отрицательно заряженными
R:
относят
асн и глн аминокислоты, имеющие в радикале
дополнительную карбоксильную группу,
при рН около 7,0 диссоциирующую с
образованием СОО- и
Н+.
Следовательно, радикалы данных аминокислот
— анионы. Ионизированные формы глутаминовой
и аспарагиновой кислот называют
соответственно глутаматом и аспартатом.
АК
с полярными положительно заряженными
R
α-Аминокислоты
могут ковалентно связываться друг с
другом с помощью пептидных связей.
Пептидная связь образуется между
α-карбоксильной группой одной аминокислоты
и α-аминогруппой другой, т.е. является
амидной связью. При этом происходит
отщепление молекулы воды.
1.
Строение пептида. Количество
аминокислот в составе пептидов может
сильно варьировать. Пептиды, содержащие
до 10 аминокислот, называют олигопептиды. Часто
в названии таких молекул указывают
количество входящих в состав олигопептида
аминокислот: трипептид, пентапептид,
окгапептид и т.д.
Пептиды,
содержащие более 10 аминокислот,
называют «полипептиды», а
полипептиды, состоящие из более чем 50
аминокислотных остатков, обычно называют
белками. Однако эти названия условны,
так как термин «белок» часто
употребляют для обозначения полипептида,
содержащего менее 50 аминокислотных
остатков. Например, гормон глюкагон,
состоящий из 29 аминокислот, называют
белковым гормоном.
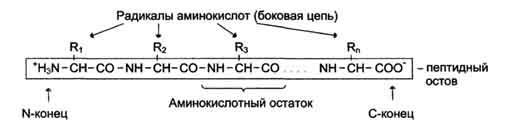
Мономеры
аминокислот, входящих в состав белков,
называют «аминокислотные
остатки». Аминокислотный
остаток, имеющий свободную аминогруппу,
называется N-концевым и пишется слева,
а имеющий свободную α-карбоксильную
группу — С-концевым и пишется справа.
Пептиды пишутся и читаются с N-конца.
Цепь повторяющихся атомов в полипептидной
цепи -NH-CH-CO-носит название «пептидный
остов».
При
названии полипептида к сокращённому
названию аминокислотных остатков
добавляют суффикс -ил, за исключением
С-концевой аминокислоты. Например,
тетрапептид Сер-Гли-Про-Ала читается
как серилглицилпролилаланин.
Пептидная
связь, образуемая иминогруппой пролина,
отличается от других пептидных связей,
так как атом азота пептидной группы
связан не с водородом, а с радикалом.
Пептиды
различаются по аминокислотному составу,
количеству и порядку соединения
аминокислот
3
Первичная структура белков. Пептидная
связь, ее характеристика (прочность,
кратность, компланарность, цис- ,транс-
изомерия). Значение первичной структуры
для нормального функционирования белков
(на примере гемоглобина S).
Первичная
структура
— понятие, обозначающее последовательность
аминокислотных остатков в белке
Пептидная связь — основной вид связи,
определяющий первичную структуру
Возможно и присутствие дисульфидных
связей между двумя остатками цистеина
в одной полипептидной цепи с образованием
цистина Такая же связь (дисульфидный
мостик) может возникать и между остатками
цистеина, принадлежащими разным
полипептидным цепям в белковой молекуле,
сополимерном образовании.
Аминокислотные
остатки в пептидной цепи белков чередуются
не случайным образом, а расположены в
определённом порядке. Линейную
последовательность аминокислотных
остатков в полипептидной цепи
называют «первичная
структура белка».
Первичная
структура каждого индивидуального
белка закодирована в участке ДНК,
называемом геном. В процессе синтеза
белка информация, находящаяся в гене,
сначала переписывается на мРНК, а затем,
используя мРНК в качестве матрицы, на
рибосоме происходит сборка первичной
структуры белка.
Каждый
из 50 000 индивидуальных белков организма
человека имеет уникальную для данного
белка первичную структуру. Все молекулы
данного индивидуального белка имеют
одинаковое чередование аминокислотных
остатков в белке, что в первую очередь
отличает данный индивидуальный белок
от любого другого
Потребность в белках для людей старше 60 лет
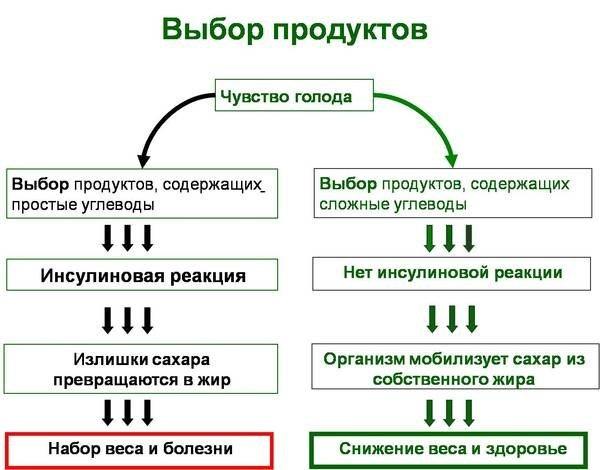
Многие недавно проведенные исследования показали, что людям старше 60 лет лучше всего употреблять от 1,0 до 1,3 г белка в день (8, 9, 10 и многие другие). Большая часть этих исследований были спонсированы или были как-либо связаны с людьми, чью работу поддерживали торговые организации отраслей животноводства (8, 9 и многие другие).
За основу своих рекомендаций они взяли предположение, основанное на ряде других исследований, согласно которым способность людей старшего возраста поддерживать мышечную и костную массу падает, и поэтому им необходимо больше белка. Этот аргумент достаточно убедителен, поэтому, несмотря на связь исследователей с индустрией животноводства, людям в пожилом возрасте стоит прислушаться к этим рекомендациям и увеличить потребление белка. Поэтому, в таблице 1 дан диапазон показателей рекомендуемой нормы потребления белка и лизина для людей в возрасте 60 лет и старше.
Критика метода азотного баланса
В 2010 году группа исследователей из Госпиталя для больных детей в Торонто выпустила работу, в которой высказалось предположение о том, что в рекомендуемой норме потребления (РНП) (которая включает РСН) недооценена белковая потребность человека (5). Один из авторов, др. Пол Б. Пенчарц, был членом комиссии, ответственной за расчет РНП для макроэлементов, и был одним из экспертов, задействованным в составлении совместного доклада по потребности в белках и аминокислотах Всемирной организации здравоохранения, Продовольственной и сельскохозяйственной организации ООН и Университета объединенных наций. В исследовании было отмечено следующее:
Настоящие рекомендации по употреблению белков для взрослых людей основаны на повторном анализе существующих исследований, в которых используется метод азотного баланса (1,12). У метода азотного баланса есть определенные методологические ограничения, в связи с чем его использование приводит к недооценке потребности в белках. Кроме того, использование одного линейного регрессионного анализа для определения азотного баланса неуместно, так как отношение потребления азота и уровня азота в организме нелинейное. На основании этого мы повторно проанализировали опубликованные исследования, в которых использовался метод азотного баланса, используя двухразовую регрессию. Результаты показали, что средняя потребность в белках составляет 0,91 г/кг/день и уровень потребления, удовлетворяющий потребность большей части населения, составляет 1 г/кг/день. Используя метод ИОА (индикатор окисления аминокислот), мы определили, что эти показатели составляют 0,93 и 1,2 г/кг/день соответственно. Эти показатели превышают существующие государственные рекомендации на 40%. Такая большая разница говорит о том, что необходимо срочно переоценить официальные рекомендации по употреблению белка для взрослых людей.
Указанные учёные также объясняют, что методологические ограничения метода азотного баланса заключаются в том, что в нём переоценивается потребление азота и недооценивается его потеря. Это приводит к неверному установлению азотного баланса при более низком уровне потребления белка.
Метод ИОА (индикатор окисления аминокислот), упомянутый выше, объясняется далее:
Метод ИОА основан на той концепции, что при нехватке одной незаменимой аминокислоты в питании окисляются все остальные аминокислоты, включая аминокислоту, которую считают индикатором (одна из незаменимых аминокислот, обычно – Л- фенилаланин)(5). С повышением потребления недостающей аминокислоты (или общего количества белка) окисление аминокислоты-индикатора понижается, что отражает включение этой аминокислоты в усваиваемый белок. Как только уровень потребляемого белка доходит до оптимального, оксидация аминокислоты-индикатора перестаёт изменяться.
Другими словами, группа этих исследователей, считает, что средняя потребность в белках составляет 0,91-0,93 г/кг/день, а уровень потребления, удовлетворяющий потребности 97-98% населения (тоже самое, что и РСН) составляет 1,0-1,2 г/кг/день.
Ввиду этих выводов, веганам лучше всего склонятся к потреблению большего количества белка.
Вводная часть
Белки необходимы для поддержания мышечной и костной массы, иммунной системы и для предотвращения утомления.
Люди, не знакомые с веганским питанием, часто предполагают, что удовлетворить потребность в белке, питаясь исключительно растительной пищей, крайне сложно. Если они вообще верят, что в растительных продуктах есть белок. С другой стороны, после прочтения различной литературы на эту тему, большинство «образованных» веганов принимают диаметрально противоположную точку зрения, согласно которой человек не может недополучить белка на веганском питании.
Правда находится где-то посередине. Если человек употребляет несколько порций бобовых в день, то ему будет легко получить достаточное количества белка на веганском питании. Однако, наверняка, есть много веганов, которые не добирают достаточного количества белка для оптимального здоровья. Веганам, которые не употребляют бобовые, может быть особенно трудно получить достаточное количество аминокислоты лизин.
Веганы, не получающие достаточного количества калорий для поддержания своего веса, также должны уделять особое внимание употреблению белка
Общие структурные особенности аминокислот, входящих в состав белков
Общая
структурная особенность АК — наличие
амино- и карбоксильной групп, соединённых
с одним и тем же углеродным атомом. R —
радикал аминокислот — в простейшем
случае представлен атомом водорода
(глицин), но может иметь и более сложное
строение.
В
водных растворах при нейтральном
значении рН —
АК существуют в виде биполярных ионов.
В
отличие от 19 остальных — АК, пролин —
Иминокислота, радикал которой связан
как с углеродным атомом, так и с
аминогруппой, в результате чего молекула
приобретает циклическую структуру.
19
из 20 АК содержат в α-положении асимметричный
атом углерода, с которым связаны 4 разные
замещающие группы. В результате эти АК
в природе могут находиться в двух разных
изомерных формах — L и D. Исключение
составляет глицин, который не имеет
асимметричного α-углеродного атома,
так как его радикал представлен только
атомом водорода. В составе белков
присутствуют только L-изомеры аминокислот.
Чистые
L- или D-стереоизомеры могут за длительный
срок самопроизвольно и неферментатив-но
превращаться в эквимолярную смесь L- и
D-изомеров. Этот процесс называют
рацемизацией. Рацемизация каждой
L-аминокислоты при данной температуре
идёт с определённой скоростью. Это
обстоятельство можно использовать для
установления возраста людей и животных.
Так, в твёрдой эмали зубов имеется белок
дентин, в котором L-аспартат переходит
в D-изомер при температуре тела человека
со скоростью 0,01% в год. В период формирования
зубов в дентине содержится только
L-изомер, поэтому по содержанию D-аспартата
можно рассчитать возраст обследуемого.
Все
20 АК в организме человека различаются
по строению, размерам и физико-химическим
свойствам радикалов, присоединённых к
α-углеродному атому.
Список литературы
1. Yáñez E, Uauy R, Zacarías I, Barrera G. Long-term validation of 1 g of protein per kilogram body weight from a predominantly vegetable mixed diet to meet the requirements of young adult males. J Nutr. 1986 May;116(5):865-72.
2. Dietary Reference Intakes: Macronutrients. National Academy of Sciences. Institute of Medicine. Food and Nutrition Board. DRI table for carbohydrate, fiber, fat, fatty acids and protein.
3. Rand WM, Pellett PL, Young VR. Meta-analysis of nitrogen balance studies for estimating protein requirements in healthy adults. Am J Clin Nutr. 2003 Jan;77(1):109-27.
4. Register UD, Inano M, Thurston CE, Vyhmeister IB, Dysinger PW, Blankenship JW, Horning MC. Nitrogen-balance studies in human subjects on various diets. Am J Clin Nutr. 1967 Jul;20(7):753-9.
5. Elango R, Humayun MA, Ball RO, Pencharz PB. Evidence that protein requirements have been significantly underestimated. Curr Opin Clin Nutr Metab Care. 2010 Jan;13(1):52-7.
6. Caso G, Scalfi L, Marra M, Covino A, Muscaritoli M, McNurlan MA, Garlick PJ, Contaldo F. Albumin synthesis is diminished in men consuming a predominantly vegetarian diet. J Nutr. 2000 Mar;130(3):528-33.
7. Calculations:
Average healthy body weight of the men based on a BMI of 22 and average height of 1.74 m = 66.6 kg78 g protein per 66.6 kg = 1.17 g/kg96 g protein per 66.6 kg = 1.44 g/kg
Actual average body weight of the men was 77 kg78 g protein per 77 kg = 1.01 g/kg96 g protein per 77 kg = 1.25 g/kg
Averageing the healthy body weight with the actual body weight gives 1.09 and 1.34 g/kg
8. Gaffney-Stomberg E, Insogna KL, Rodriguez NR, Kerstetter JE. Increasing dietary protein requirements in elderly people for optimal muscle and bone health. J Am Geriatr Soc. 2009 Jun;57(6):1073-9.
9. Paddon-Jones D, Short KR, Campbell WW, Volpi E, Wolfe RR. Role of dietary protein in the sarcopenia of aging. Am J Clin Nutr. 2008 May;87(5):1562S-1566S.
10. Morais JA, Chevalier S, Gougeon R. Protein turnover and requirements in the healthy and frail elderly. J Nutr Health Aging. 2006 Jul-Aug;10(4):272-83.
11. Doyle MD, Morse LM, Gowan JS, Parsons MR. Observations on nitrogen and energy balance in young men consuming vegetarian diets. Am J Clin Nutr. 1965 Dec;17(6):367-76.
12. Haddad EH, Berk LS, Kettering JD, Hubbard RW, Peters WR. Dietary intake and biochemical, hematologic, and immune status of vegans compared with nonvegetarians. Am J Clin Nutr. 1999 Sep;70(3 Suppl):586S-593S.
13. Position of the American Dietetic Association, Dietitians of Canada, and the American College of Sports Medicine: Nutrition and Athletic Performance. J Am Diet Assoc. 2009;109:509-527.
Также просмотрено
Evans WJ. Protein nutrition, exercise and aging. J Am Coll Nutr. 2004 Dec;23(6 Suppl):601S-609S.
Химические реакции, используемые для обнаружения аминокислот
Способность
аминокислот вступать в те или иные
химические реакции определяется наличием
в их составе функциональных групп. Так
как все аминокислоты, входящие в состав
белков, содержат у ?-углеродного атома
амино- и карбоксильную группы, они могут
вступать в характерные для всех
аминокислот химические реакции. Наличие
каких-либо функциональных групп в
радикалах индивидуальных аминокислот
определяет их способность вступать в
специфичные для данных аминокислот
реакции.
Нингидриновая
реакция на ?-аминокислоты
Для
обнаружения и количественного определения
аминокислот, находящихся в растворе,
можно использовать нингидриновую
реакцию.
Эта
реакция основана на том, что бесцветный
нингидрин, реагируя с аминокислотой,
конденсируется в виде димера через атом
азота, отщепляемый от ?-аминогруппы
аминокислоты. В результате образуется
пигмент красно-фиолетового цвета.
Одновременно происходит декарбоксилирование
аминокислоты, что приводит к образованию
СО2 и
соответствующего альдегида. Нингидриновую
реакцию широко используют при изучении
первичной структуры белков (см. схему
ниже).
Так
как интенсивность окраски пропорциональна
количеству аминокислот в растворе, её
используют для измерения концентрации
?-аминокислот.
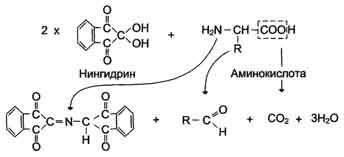
Нингидриновая
реакция, используемая для определения
?-аминокислот
Специфические
реакции на отдельные аминокислоты
Качественное
и количественное определение отдельных
аминокислот возможно благодаря наличию
в их радикалах особенных функциональных
групп.
Аргинин
определяют с помощью качественной
реакции на гуанидиновую группу (реакция
Сакагучи), а цистеин выявляют реакцией
Фоля, специфичной на SH-группу данной
аминокислоты. Наличие ароматических
аминокислот в растворе определяют
ксантопротеиновой реакцией (реакция
нитрования), а наличие гидроксильной
группы в ароматическом кольце тирозина
— с помощью реакции Миллона.
Физические
свойства
По
физическим свойствам аминокислоты
резко отличаются от соответствующих
кислот и оснований. Все они кристаллические
вещества, лучше растворяются в воде,
чем в органических растворителях, имеют
достаточно высокие температуры плавления;
многие из них имеют сладкий вкус. Эти
свойства отчётливо указывают на
солеобразный характер этих соединений.
Особенности физических и химических
свойств аминокислот обусловлены их
строением — присутствием одновременно
двух противоположных по свойствам
функциональных групп: кислотной и
основной. α-Аминокислоты являются
амфотерными электролитами.
Общие
химические свойства
Все
аминокислоты-амфотерные соединения,
они могут проявлять как кислотные свойства,
обусловленные наличием в их молекулах
карбоксильной группы —COOH,
так и основныесвойства,
обусловленные аминогруппой —NH2.
Аминокислоты взаимодействуют с кислотами
и щелочами:
NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная
соль глицина)
NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая
соль глицина)
Растворы аминокислот
в воде благодаря этому обладают
свойствами буферных
растворов,
то есть находятся в состоянии внутренних
солей.
NH2 —CH2COOH N+H3 —CH2COO—
Аминокислоты
обычно могут вступать во все реакции,
характерные для карбоновых
кислот и аминов.
Этерификация:
NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый
эфир глицина)
Важной
особенностью аминокислот является их
способность к поликонденсации,
приводящей к образованию полиамидов,
в том числе пептидов,
белков, нейлона, капрона. Реакция
образования пептидов:
Реакция
образования пептидов:
HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической
точкой аминокислоты
называют значение pH,
при котором максимальная доля молекул
аминокислоты обладает нулевым зарядом.
При таком pH аминокислота наименее
подвижна в электрическом поле, и данное
свойство можно использовать для
разделения аминокислот, а также белков
и пептидов.
Цвиттер-ионом называют
молекулу аминокислоты, в которой
аминогруппа представлена в виде -NH3+,
а карбоксигруппа — в виде -COO−.
Такая молекула обладает значительным
дипольным моментом при нулевом суммарном
заряде. Именно из таких молекул построены
кристаллы большинства аминокислот.
Некоторые
аминокислоты имеют несколько аминогрупп
и карбоксильных групп. Для этих аминокислот
трудно говорить о каком-то конкретном
цвиттер-ионе.
Получение
Большинство
аминокислот можно получить в ходе гидролиза
белков или
как результат химических реакций:
CH3COOH + Cl2 +
(катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3 → NH2 —CH2COOH + NH4Cl
Белковое питание должно быть полноценным.
Белки
присутствуют во всех клетках, поэтому
и растения, и животные могут быть
источником белков
Белки
пищевых продуктов (г на 100 г).
|
Растительные |
Животные |
||
|
белок |
Белок |
||
|
мука |
13.7 |
говядина |
20.3 |
|
Рис |
6.7 |
говядина |
8.8 |
|
Бобы |
5.7 |
Свинина |
20.7 |
|
Горох |
6.9 |
свинина |
6.8 |
|
Картофель |
1.6 |
Телятина |
21.1 |
|
Кедровые |
3.9 |
Цыплята |
20.5 |
|
Бананы |
1.1 |
Лосось |
18.8 |
С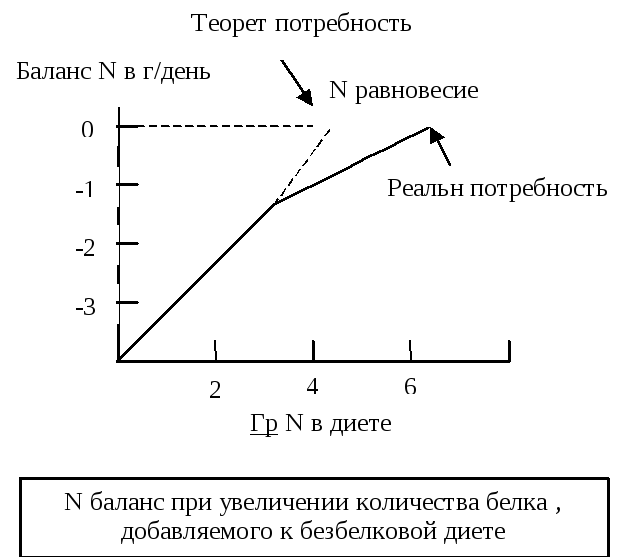 уточная
уточная
потребность в белках
определяется на основании изучения
общих потерь азота за сутки человеком,
находящимся на безбелковой диете
Схема
определения суточной потребности в
белках на основании определения
количества белка, необходимого для
замещения обязательных потерь азота.
(коэффициент
изнашивания) и количества белка,
необходимого для замещения этих
обязательных потерь. Коэффициент
изнашивания – это количество азота,
которое выделяется у человека, находящегося
на безбелковой диете. Он соответствует
примерно 20
г белка.
Главные
пути обязательных потерь азота у человека
представлены на рис..
У
взрослых потребность в азоте определяется
количеством белка, необходимого для
поддержания азотистого баланса.
Дополнительные количества белка
необходимы женщинам во время беременности
и лактации. У новорожденных и детей
потребность в белке определяется в
большей мере оптимизацией роста, чем
азотистым балансом.
.
Основные
пути обязательных потерь белков у
человека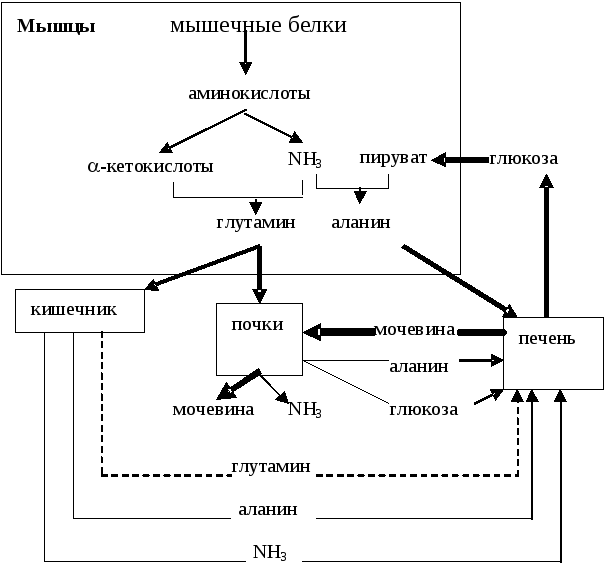
Белковая
потребность отдельных людей определяется
следующими факторами:
-
Возраст:
белковая потребность у растущих детей
выше, чем у взрослых -
Беременность:
во время беременности приблизительно
950 г нового белка прибавляется у матери,
необходимого плоду и развитию
репродуктивных тканей. -
Лактация:
Ежедневная продукция молока у матери
около 850 мл. Содержание белка в молоке
1.2 %.. Поэтому требуются дополнительное
количество белка в диете. -
Период
реабилитации после болезни: выздоравливающий
после болезни или после белкового
голодания человек нуждается в
дополнительных количествах белка,
необходимых для восполнения потерь
белков в тканях. -
Катаболические
состояния: при таких состояниях как
хирургическая операция, сепсис или
травма также повышается потребность
в белках.
Усвоение белков зависит
от:
-
Качества белков: качество белка
определяется возможностью белка
удовлетворить потребность организма
в необходимых аминокислотах. -
Возможности протеаз переварить белок.
Не перевариваемые белки не усваиваются. -
Калорийной ценности пищи: белок может
хорошо усваиваться в том случае, если
пища содержит достаточное количество
калорий. Если калорийность пищи низкая,
больше белка используется в качестве
источника энергии и поэтому выше
потребность в белке.
Биологическая ценность белковзависит, в первую очередь, от содержания
в нем незаменимых аминокислот. Эталоном
биологической ценности являются белки
яиц (обозначается цифрой 100). Белки
животных имеют более высокую биологическую
ценность, чем белки из растений. Белки,
не содержащие хотя бы одной из незаменимых
аминокислот, не имеют биологической
ценности. В развитых странах белки диеты
среднего человека имеют биологическую
ценность около 70.
В смешанной пище дефицит одной незаменимой
смешанной пище дефицит одной незаменимой
аминокислоты в одном белке может
компенсироваться другим белком. Например,
пшеница содержит мало лизина, но богата
метионином, а бобовые богаты лизином,
но содержат мало метионина. Поэтому
совместное использование этих белков
может иметь высокую биологическую
ценность
Потребность
в белке выше во время роста, когда белки
накапливаются (степень синтеза белков
превалирует над их распадом). Для
возмещения обязательных потерь у
взрослых необходимо примерно 0.47 г/кг/день
азота. Это значение увеличивается на
30% для поправки на популяционные вариации
и достигает 0.6 г/кг/день. Учитывая значение
биологической ценности, равное 70 (см.
выше) необходима коррекция еще на 30%,
что повышает потребность в азоте до 0.8
г/кг/день.
Избыточное
поступление белков оказывает
неблагоприятное воздействие на процессы
жизнедеятельности. Все белки в клетке
и организме выполняют структурные или
физиологические функции. Белки в отличие
от углеводов и липидов не запасаются в
организме и избыточное поступление
белка вызывает усиление его распада.
Продолжительное поступление большого
количества белков у человека способствует
-
Избыточному
накоплению липидов. «Лишние» аминокислоты
распадаются и углеводородные скелеты
этих аминокислот превращаются в липиды -
Потере
кальция. Избыток белка в питании вызывает
потерю кальция почками, что ведет к
остеопорозу, особенно у женщин.
Повышению
функциональной нагрузки на почки.
Избыточное поступление белков вызывает
повышение функциональной активности
почек.
Модифицированные аминокислоты, найденные в составе белков
после
окончания их синтеза. Введение
дополнительных функциональных групп
в структуру аминокислот придаёт белкам
свойства,
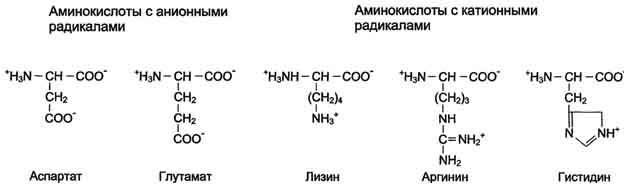
Схема.
Структура полярных заряженных аминокислот
в диссоциированной форме
Таблица
1-3. Изменение суммарного заряда аминокислот
в зависимости от рН среды

необходимые
для выполнения ими специфических
функций. Так, ?-карбоксиглутаминовая
кислота входит в состав белков, участвующих
в свёртывании крови, и две близко лежащие
карбоксильные группы в их структуре
необходимы для связывания белковых
факторов с ионами Са2+.
Нарушение карбоксилирования глутамата
приводит к снижению свёртываемости
крови.
Значение
гидроксильных групп в составе лизина
и пролина описано в разделе 15.